Hvad er alkohol?

Lær om alkohols kemiske strukturer og fysiske egenskaber samt hvordan alkohol fremstilles.
Alkohol er en gruppe molekyler inden for det, man kalder organiske forbindelser. Alle alkoholer indeholder en eller flere OH-grupper (hydroxid), som er bundet til en kæde af carbonatomer.
Den alkohol, der indgår i øl, vin og spiritus, hedder ethanol. Ethanol består af grundstofferne kul (carbon = C), brint (hydrogen = H) og ilt (oxygen = O). Ethanol skrives således: CH3CH2OH. Ethanol er klart som vand. Ethanol har et kogepunkt på 78,4 °C, det vil sige, at det koger ved en lavere temperatur end vand, der koger ved 100 °C. Ethanol har et frysepunkt på ca. -114 °C. Ethanol har en massefylde (densitet) på 0,789 g/cm3, det vil sige, at det er lettere end vand, som har en massefylde på 1g/cm3. Desuden har ethanol en karakteristisk lugt og en brændende smag. Og der går let ild i ethanol, som brænder med en svag blålig farve.
Figur 1. Sammensætningen af et ethanolmolekyle som streg- og kuglemodel.
Lav opgave 1. Struktur af alkoholer og deres fysiske egenskaber
Alkohol er et organisk opløsningsmiddel
Alkohol har en speciel egenskab: Det kan både opløses i vand, og samtidig kan det opløse fedtstoffer. Det hænger sammen med alkoholmolekylets opbygning. I den ene ende er molekylet hydrofilt – det vil sige ”vandelskende”, og det gør, at denne ende kan binde sig til vand. I den anden ende er molekylet hydrofobt - det vil sige, at det ”hader vand”. Denne ende er derfor vandskyende – til gengæld kan det binde sig til fedt, som dermed kan opløses. Den evne udnytter man i rengøringsmidler. Alkohol er et godt rengøringsmiddel, fordi det både kan opløses i vand og opløse fedt. Når man f.eks. pudser vinduer, kan alkoholen i rengøringsmidlet opløse fedtpletter på ruden. Og samtidig kan fedtet og alkoholen opløses i vand, så man kan fjerne både fedt, vand og alkohol fra ruden. Det er den samme opløsende evne, der gør, at alkohol kan skade din hjerne. Dine nerveceller er nemlig isoleret med fedt. Det får bl.a. nervesignalerne til at løbe hurtigt og hen til de rigtige steder i hjernen. Hvis du har drukket alkohol, bliver det ført op i din hjerne via blodet. Her begynder det at opløse fedtet rundt om dine hjerneceller. Det kan forstyrre signalerne – du bliver sløv, og din reaktionsevne bliver langsommere.
Lav forsøg 1: Alkoholers opløselighed og egenskaber

Alkohol i hverdagen
Alkohol er et effektivt stof. Det findes i mange forskellige produkter, som ikke er beregnet til at spise eller drikke. Det er bl.a.:
- Håndsprit. Her er alkoholprocenten høj (over 60%), da høje koncentrationer af alkohol dræber bakterier og vira.
- Husholdningssprit
- Brændstof, som bioethanol
- Benzin
- Sprinkler- og kølervæske
- Parfume, lim og maling, hvor alkohol gør produktet mere flydende. Når man f.eks. har malet en væg, fordamper opløsningsmidlet, og derved hærder malingen. Når alkoholen fordamper, kan man få det ned i lungerne, hvor det bliver optaget i blodet. Derfor er det vigtigt, at man beskytter sig med åndedrætsværn, når man arbejder med maling, der indeholder alkoholer.
Lav opgave 2: I hvilke produkter findes der alkohol?
Fremstilling af alkohol
Man kan fremstille alkohol på mange forskellige måder. Den mest almindelige proces har været brugt i mange århundreder. Her tager man organiske produkter, der indeholder sukkerstoffer, og får dem til at gære. Det kan være kartofler eller frugt.
For at lave alkohol, skal gæringen foregå uden ilt. Derfor skal gæringen ske i en lukket beholder. Ved gæring uden ilt bliver der dannet både alkohol og kuldioxid. Hvis gærcellerne får ilt, danner de vand og kuldioxid i stedet for alkohol og kuldioxid. Kuldioxid bliver til en gas ved stuetemperatur, og den fordamper i gæringsprocessen.
Når en gærcelle forbrænder sukker, får den mest energi ud af det, hvis der er ilt tilstede. Så omdanner gærcellen sukkeret helt til kuldioxid og vand. Men i et lukket gæringskar opbruger gærcellerne ilten. Nu får de mindre energi ud af sukkeret, og i stedet for kuldioxid og vand dannes der alkohol og kuldioxid.
Se figur 2. Gæring af sukkerstoffet glukose uden ilt
Alkohol er giftig for gærcellerne. Så når koncentrationen af alkohol i gæringsbeholderen kommer op på ca. 12 %, stopper væksten af gærcellerne. Dermed dannes der ikke mere alkohol. Hvis man vil opnå en højere koncentration end 12 % alkohol, skal alkoholen destilleres. Destillation betyder, at man adskiller to eller flere stoffer ved kogning.
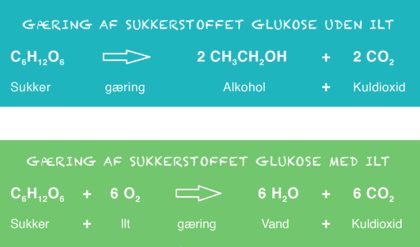
Figur 2. Gæring af sukkerstoffet glukose uden ilt

Destillation af alkohol
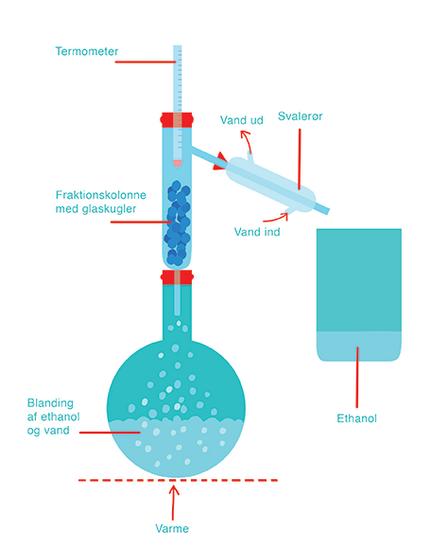
Man har destilleret alkohol i mange hundrede år – f.eks. når man har fremstillet stærke alkoholiske drikke som cognac ud fra vin og øl. Når man destillerer, skal man kende kogepunktet for de forskellige stoffer, der er i den blanding, man vil destillere. Når man f.eks. opvarmer en blanding af vand og alkohol, begynder ethanolen at fordampe før vandet, fordi ethanol allerede koger ved 78,4 °C. Nu kan dampen fra ethanolen opsamles i det, der hedder et svalerør. Det er en rørspiral, der ligger i et kar med koldt vand, og det gør, at ethanol-dampen kondenserer – det vil sige, den bliver til væske igen. Væsken – eller kondensatet er ethanol, som nu kan opsamles i et glas (se figur 2).
Figur 3. Opstilling af destillation i et laboratorium.
Der kan opstå fejl i både gæringen og destillationen. Så kan der bl.a. dannes træsprit (methanol). Træsprit er svært at opdage, fordi det hverken har en speciel lugt eller farve. Det er farligt at drikke træsprit. I løbet af 12-24 timer kan man få hovedpine, kvalme, opkastninger og mavesmerter. Skaderne er alvorlige, og man kan risikere nedsat syn eller blindhed, skælven, stivhed, mekaniske bevægelser og ved større indtag koma og død.
Lav forsøg 2. Gæring af sukkerstof
Lav opgave 3. Hvad er gæring og hvor anvendes gæring?

Figur 1. Sammensætning af et ethanolmolekyle som streg- og kuglemodel
OPGAVE 1: STRUKTUR AF ALKOHOLER OG DERES FYSISKE EGENSKABER
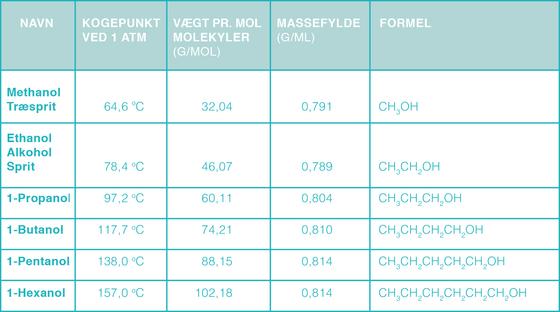
Der er forskellige typer af alkoholer. Tabel 1 viser nogle af de mest simple alkoholer og deres formel og fysiske egenskaber. Brug denne tabel til følgende:
- Byg de forskellige alkoholmolekyler med skolens molekylebyggesæt og tegn dem på en overskuelig måde, så I kan se hvordan atomerne er sat sammen
- Prøv om I kan lave andre alkoholer med det samme antal atomer af C, H og O, i de modeller I har lavet
- Hvordan ændres vægten af alkoholmolekylerne?
- Er der en sammenhæng mellem alkoholmolekylernes struktur og deres kogepunkt og massefylde?
- Kan I forklare denne sammenhæng?
Tabel 1: Her er nogle eksempler på alkoholer, deres kemiske navne, deres hverdagsnavne, kogepunkt, vægt pr. molekyle, massefylde (vægt pr. ml), formel og struktur:
FORSØG 1: ALKOHOLERS OPLØSELIGHED OG EGENSKABER
Formål: At undersøge forskellige alkoholers opløselighed i vand
Materialer:
- Find de alkoholer, der er i skolens kemikalieskab og en letflydende olie
- Reagensglas og reagensglasholdere
- 200 ml bægerglas med mulighed for at varme vand op til kogning (opvarmningen skal ikke foregå med åben ild)
- Termometer til over 100 oC
Fremgangsmåde:
- Bland de forskellige alkoholer i hhv. vand og den letflydende olie.
- Prøv om alkoholerne kan blandes med vand, når der også er en letflydende olie i blandingen.
- Opvarm de forskellige alkoholer i det kogende vandbad og iagttag om de koger og fordamper, samt hvilken temperatur vandbadet har opnået, når alkoholen koger.
Behandling af resultater:
- Hvad er forskellen på de forskellige alkoholer?
- Hvordan er sammenhængen mellem alkoholernes struktur og opløseligheden i vand?
- Kunne alkohol og vand blandes, når der var letflydende olie i vandet? Hvis ja, hvorfor?
- Hvordan er alkoholernes mulighed for at fordampe - og ved hvilke temperaturer? (se tabel 1 i opgave 1)
OPGAVE 2: I HVILKE PRODUKTER FINDES DER ALKOHOLER?
Der er forskellige former for alkoholer i mange af vores hverdagsprodukter. Undersøg hjemme hos dig selv hvilke produkter på badeværelset, køkkenet, redskabsrum, kemikalieskab m.v., der indeholder alkoholer.
Kig ikke kun efter ethanol, men også andre former for alkohol.
Se på varedeklarationen, hvad produkterne indeholder. Alkoholer har for det meste endelsen –ol. Skriv ned, hvad du har fundet eller tag foto af produkterne. Medbring det til næste skoletime. Diskutér, hvorfor de forskellige alkoholer er i produkterne, og hvilken funktion de har.
FORSØG 2: GÆRING AF SUKKERSTOF
Formål: At finde ud af, hvad der sker ved gæringen, og hvad der kan påvirke gæringsresultatet.
Materialer:
- 1 liter kolbe (eller tilsvarende beholder)
- Gummiprop og tilhørende boblerør
- Glasrør og gummislanger
- Elektronisk vægt
- 700 ml vand, 70 g sukker og 25 g gær
Boblerøret kan være et købt gærrør. Man kan også selv lave det ved at lade et glasrør udmunde i bundet af et reagensglas fyldt med vand.
Fremgangsmåde: Vand, sukker og gær blandes grundigt i kolben, hvorefter prop med boblerør sættes ned. Vær sikker på, at der er vand i boblerøret under hele gæringsprocessen.
Placer gæringskolben på en elektronisk vægt og et lunt sted.
Data: Følg gæringskolbens vægt og noter dette løbende over de næste 14 dage. Lav løbende en optælling af antal bobler pr. minut.
Behandling af data: Lav en kurve over henholdsvis ændringen i vægten og antal bobler pr. minut i forhold til tiden.
Svar på følgende spørgsmål:
- Forklar vægtændringen
- Hvad er det, der bobler ud af boblerøret?
- Forklar forskellen i antal bobler pr. minut over den periode, som gæringen har foregået
- Hvad var temperaturen, hvor gæringskolben stod? Hvilken betydning har temperaturen for resultatet?
OPGAVE 3: HVAD ER GÆRING, OG HVOR ANVENDES GÆRING?
Ved gæring af sukker kan man fremstille alkohol. Men hvad kan man ellers bruge end sukker?
- Hvilke alkoholgæringer kan man foretage hjemme og hvordan?
- Hvilke alkoholprodukter i Danmark bliver fremstillet af virksomheder og hvordan?
Gæring kaldes også fermentering. Det bruges til mange andre produktioner.
- Hvilke medicinalfirmaer i Danmark bruger gæring til at producere nogle af deres produkter?
- Hvilke andre produktioner anvender gæring i industrien?
- Hvornår bruger man gæring derhjemme? Og hvordan?
Gæringen kan gå galt, så der opstår uheldige produkter.
- Hvad kan gå galt ved en gæring?
Aftal i klassen, at I gruppevis undersøger overstående på internettet, så hver gruppe tager hvert sit emne. Lav en kort præsentation af jeres resultat for de andre i klassen.
Hvad er et molekyle?
Et molekyle er en samlet enhed af atomer.
Hvad er en organisk forbindelse?
En organisk forbindelse består af en kæde af mindst to kulstof-atomer. Ethanol er en organisk forbindelse, som består af to kulstofatomer, der sidder sammen med fem brintatomer og en alkoholgruppe. De fleste organiske forbindelser er dannet af levende organismer.
Hvad er gær?
Gær er en svamp, som også kaldes gærsvamp. Gærceller er ganske små. I en pakke bagegær på 50 gram er der ca. 500 milliarder gærceller. Svampene får energi ved at nedbryde organisk materiale. Det kan f.eks. komme fra sukker. Derfor får gærsvampe i alkoholproduktion typisk tilført sukkerstoffer som energi.
Figur 3. Opstilling af destillation i et laboratorium